

近年来,随着我国人口老龄化加快,急性心血管疾病发病率增加,因急性胸痛就诊的患者人数也逐年递增。急性胸痛临床表现不一、病情变化迅速、危险性差异悬殊、预后与疼痛程度不完全相关、救治时间依赖性强。随着胸痛中心建设的推广,我国胸痛诊疗日趋规范,但我国幅员辽阔、急诊诊疗能力存在差异,误诊、漏诊仍时有发生。因此,作为急性胸痛救治的第一站,院前急救和急诊科需快速评估、准确鉴别并科学处理,进而高效救治、合理分流胸痛患者。目前,院前急救与急诊科仍缺少急性胸痛急诊诊疗的指导性专家共识。为此,按照急性胸痛救治流程“早期诊断,危险分层,正确分流,科学救治”的指导方针,中华医学会急诊医学分会联合中国医疗保健国际交流促进会胸痛分会,组织院前急救、急诊医学、心血管病学等相关学科的专家共同撰写本共识。本共识强调“战线前移”,着眼整合区域救治网络,突出社区医疗、院前急救到急诊科、专科治疗的体系建设,并延伸至患者二级预防的全程管理 ;以急性胸痛早期流程优化和快速准确鉴别为重点,体现急诊特色的动态评估观念,加强多学科协作共赢,凸显急性胸痛救治应依托传统急诊急救基础建立起大平台、大数据体系进行全程管理、多环节和交叉学科协调融合的重要性。
1 急性胸痛救治现状
急性胸痛是临床上最常见的症状之一 , 是以胸痛为主要表现的一组异质性疾病群 。不同病因导致的胸痛既可相似,又有不同特征,表现可以是不同部位、不同性质和不同程度的疼痛,其伴随症状亦各不相同。急性胸痛病因繁多、病情严重性差异极大,不仅包括急性冠状动脉综合征(acute coronary syndrome,ACS)、以急性主动脉夹层(acuteaortic dissection, AAD)为主的急性主动脉综合征(acuteaortic syndrome,AAS)、 以 急 性 肺 栓 塞(acute pulmonaryembolism, APE)为主的“急性肺动脉综合征”及张力性气胸(tension pneumothorax)等高危胸痛,也包括稳定性冠心病、胃食管反流病、肋间神经痛、神经官能症等中低危胸痛 。
胸痛患者获得医疗救助过程中有 5 个重要环节 :患者、社区医师、调度中心、急救车和急诊科,各环节均能影响胸痛患者诊疗效率。我国胸痛救治现状存在以下问题 :部分患者对胸痛认知度和应变能力差,常有患者就诊“延误”;院前及远程救治能力相对薄弱,院前院内无缝衔接仍需完善 ;各级医疗单位间协同救治配合欠流畅 ;院内各专业会诊为主的传统模式亟待进一步优化。本共识通过规范和完善胸痛急诊救治体系,对提升急性胸痛各环节诊疗水平,改善患者预后具有重要的现实应用价值。
2 社区医疗和院前急救
社区医疗和院前急救是生命抢救的起点,是胸痛诊疗“战线前移”的重要环节。急救药物、监测检验、信息技术的支撑、政策的支持是提高社区和院前救治效率的关键。社区和院前急救紧密相连,将有利于胸痛知识的普及推广、院前院内的顺畅衔接、完善患者预警机制和交接制度,使院前急救管理更加高效规范,最终促进区域内急性胸痛救治能力的提升 。提升急性胸痛诊疗能力应重视社区医疗的参与和基层人才的培养。社区与院前早期明确胸痛诊断并采取急救措施,能够更好的提高胸痛诊疗效果、改善预后。针对社区和院前急救医护团队开展院前现场快速识别 [ 心电图、即时检验(point-of-care testing, POCT)等 ]、院前早期处理及分流等培训,并借助信息化手段,可显著提高社区和院前急性胸痛救治能力。
3 危险分层与病情评估
胸痛病因繁多,需立即对胸痛的危险程度作出评估 ( 见图 1)。致命性胸痛需要立即进入抢救流程,中危胸痛需动态评估与监测,低危胸痛需合理分流 。
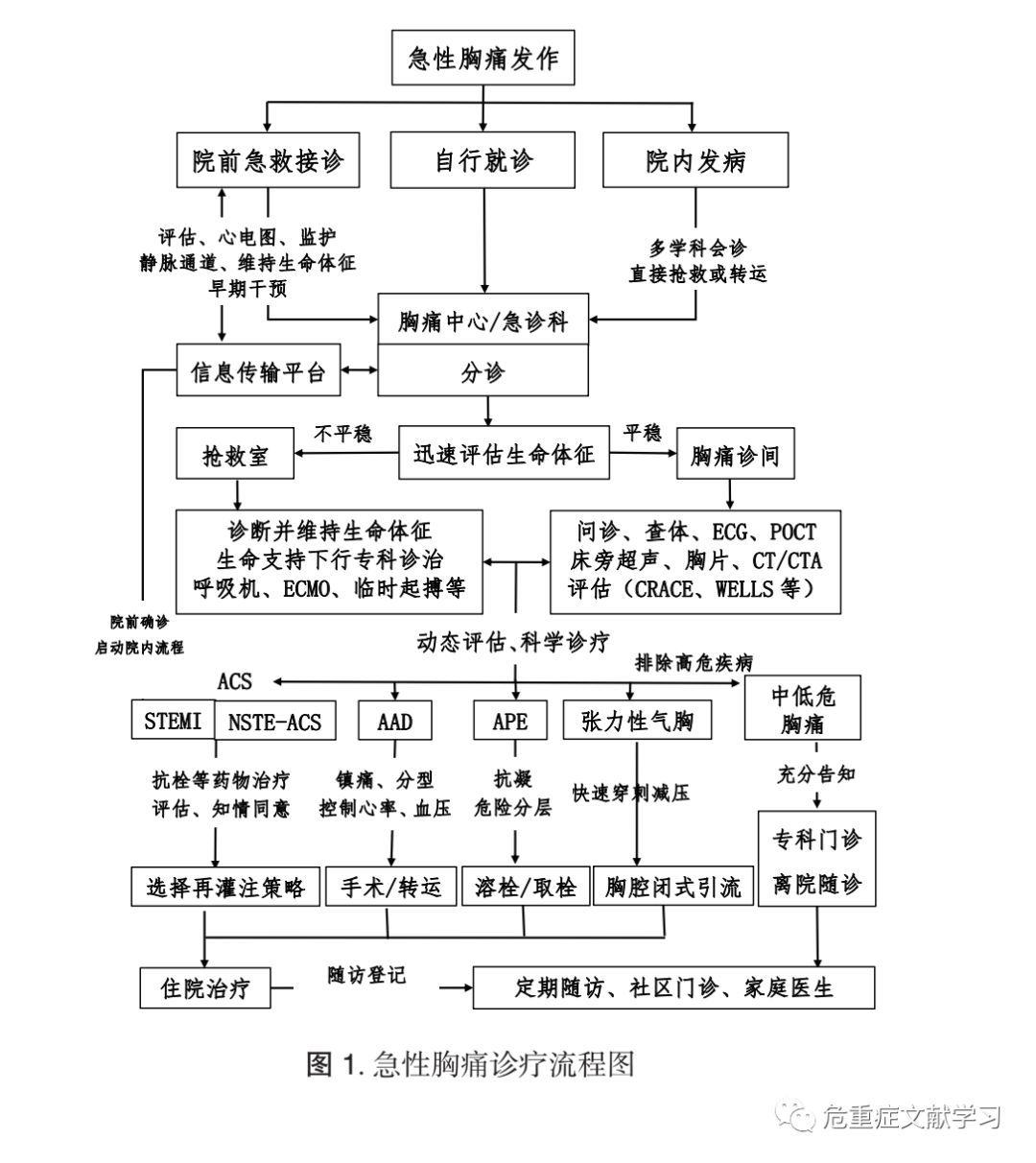
3.1 急性非创伤性胸痛急诊分诊策略
3.1.1 胸痛且伴有下列任一情况者,应当立即进入监护室或抢救室 :(1)意识改变 ;(2)动脉血氧饱和度低(<90%),呼吸衰竭 ;(3)血压显著异常 ;(4)影响血流动力学的严重心律失常 ;(5)既往有冠心病史,此次发作使用硝酸酯类药物不缓解 ;(6)既往有马凡综合征,伴有严重高血压 ;(7)伴呼吸困难,患侧胸廓饱满。
3.1.2 胸痛伴有下列任一情况者,应当尽快进行监护,并完善相关检查 :(1)长期卧床、长途旅行者,突发胸痛且持续不缓解 ;(2)确诊肿瘤、下肢静脉血栓者突发胸痛且持续不缓解;(3)既往无冠心病史,突发胸痛伴有喘憋;(4)伴咯血 ;(5)近 4 周内有手术,并有制动史 ;(6)合并多种心血管病高危因素 ;(7)长期高血压控制不佳 。
3.1.3 下列胸痛患者可常规就诊 :(1)不伴有上述情况的胸痛;(2)有胸壁压痛的胸痛;(3)与呼吸相关的胸痛;(4)超过一周的轻度胸痛。
3.2 致命性胸痛的判断
接诊胸痛患者后,除关注患者血流动力学、心脏电活动外,还应注意胸痛持续时间,结合病史、症状、查体、辅助检查等快速识别高危 ACS、 AAD、 APE、张力性气胸等致命性胸痛疾病。
3.2.1 病史 :(1)是否有高血压病、糖尿病、血脂异常、吸烟史、冠心病家族史等心血管危险因素 ;(2)是否有长途乘车和飞行史、下肢静脉炎、骨折、卧床等深静脉血栓形成危险因素 ;(3)是否有肺大疱、肺结核等慢性肺病病史或剧烈咳嗽、体型瘦长等危险因素。
3.2.2 症状 : ACS 症状主要包括发作性胸部闷痛、压迫感或憋闷感,甚或濒死感,部分患者可放射至上肢、后背部或颈部,劳累、情绪激动、气候骤变等均可诱发,持续数分钟至数十分钟,休息或硝酸甘油可缓解,持续时间超过 20 min 未缓解,需考虑急性心肌梗死的可能性 ; AAD 及大血管疾病多表现为持续撕裂样胸、背痛,可伴血压明显升高、双侧肢体血压差别较大等;APE 常伴呼吸困难或咯血,常同时合并氧饱和度下降,甚或晕厥、猝死 ;张力性气胸患者表现为极度呼吸困难,缺氧严重者出现发绀、甚至窒息。
3.2.3 查体 :要注意血压数值及四肢血压是否对称、有无心脏和外周血管杂音、肺动脉第二心音是否亢进、双肺呼吸音是否对称、下肢周径是否存在不对称、有无静脉炎或水肿等情况 。
3.2.4 辅助检查 :所有胸痛患者在首次医疗接触后应在 10min 内完成心电图检查,并动态观察 ;根据疑似诊断选择肌钙蛋白、 D- 二聚体、脑钠肽、血气分析、出凝血功能、血生化检验等 ;超声、 X 线、 CT、 CTA 等(胸痛三联 CTA可同时鉴别 ACS、 AAD、 APE 三种高危胸痛)也是辅助胸痛患者明确诊断并评估病情的常用手段 。
3.3 中低危胸痛的诊断与评估
在中低危胸痛鉴别诊断中,应综合考虑各种疾病可能,包括心源性和非心源性疾病。诊断与评估策略如下 :
3.3.1 对于所有患者,均应立即行心电图检查。
3.3.2 对于诊断不明确的患者,应选择合适的 POCT 或影像学检查,并根据病情复查心电图等。
3.3.3 对于症状提示为非心源性胸痛的患者,需要鉴别的疾病至少包括以下病种:(1)呼吸系统疾病。气胸、胸膜炎、胸膜肿瘤、肺部感染等;(2)消化系统疾病。胃食管反流病、自发性食管破裂、食管动力疾病、食管裂孔疝、食管癌等 ;(3)胸壁疾病。急性肋软骨炎、肋骨骨折、胸椎疾病、带状疱疹和肿瘤等 ;(4)神经精神疾病。颈椎 / 脑血管疾病、神经官能症等 ;(5)纵隔疾病。纵隔气肿、纵隔肿瘤、纵隔炎等 ;(6)其他。强直性脊柱炎、急性白血病、多发性骨髓瘤等。
3.3.4 对于再次评估为中低危的胸痛患者,应科学救治、及时分流,安排患者住院、离院或专科就诊。
(1)依据诊疗指南制定患者的药物治疗方案,包括早期药物治疗及长期预防方案。
(2)对患者进行详细的出院指导,应告知诊断、预后、随访时间和注意事项等,并向患者说明疾病的表现、发生紧急情况时呼叫救护车或到急诊科就诊的重要性。
3.3.5 对于未完成全部评估而提前离院的胸痛患者,接诊医师应告知其潜在的风险、症状复发时的紧急处理和预防措施等事项,签署并保存相关医疗文书。
3.3.6 ACS、 AAD、 APE 等疾病需长期服药、逐步康复和防治复发,建议针对此类疾病可建立院内专病随访中心(有条件的医院鼓励开展门诊面访),统一管理、登记、指导,做到包括预防、救治、康复在内的患者“全程管理”。
3.3.7 对于从急诊完成评估的中低危胸痛患者,医师应根据病情制定后续诊疗和随访计划,有专职医护人员定期开展电话随访工作并有完善的随访记录,开展健康宣教。
4 辅助检查
4.1 心电图
所有患者在首次医疗接触后应尽快完成常规十二导联心电图,必要时需加做后壁、右室导联并根据病情及时复查。
(1)心电图是诊断 ACS 的主要检查手段,建议首次医疗接触后 10 min 内完成心电图并需根据临床情况及时复查 。
(2)急性主动脉夹层心电图改变的主要原因包括 :①原发病,如高血压、马凡综合征、冠心病等 ;②少数患者会累及冠状动脉开口引起急性心肌梗死,故心电图诊断心肌梗死也应警惕 AD。
(3)急性肺栓塞患者心电图常有不同程度的改变,但缺乏特异性,容易误诊为其他疾病。常见心电图表现 :心律失常(窦性心动过速、心房扑动、心房颤动、房性心动过速及房性期前收缩等);非特异性 ST-T 改变,右胸导联T 波倒置 ; S Ⅰ Q Ⅲ或 S Ⅰ Q Ⅲ T Ⅲ ;右束支传导阻滞 ;甚至完全正常 。
(4)部分气胸患者心电图可表现为顺钟向转位、左胸导联 QRS 低电压现象。右侧气胸最突出的表现是 QRS 电压与呼吸周期呈一致性变化,通常称“电压交替” 。
4.2 实验室检查
对于急性胸痛患者,快速实验室检查有利于迅速明确诊断、完善评估、指导治疗。 POCT 是急性胸痛急诊诊疗的重要工具之一。
4.2.1 心肌损伤标志物
目前诊断缺血性胸痛常用的心肌损伤标志物包括心肌肌钙蛋白(cardiac troponin, cTn)、 肌酸 激 酶 同 工 酶 MB(creatine kinase isoenzymes MB, CKMB)和肌红蛋白(myoglobin, MYO。高敏 cTn(highsensitivity cardiac troponin, hs-cTn)的敏感度更高,常用来早期筛查及排除诊断。心肌型脂肪酸结合蛋白(heart-typecytoplasmic fatty acid-binding protein, H-FABP)、缺血修饰白蛋白(ischemia modifi ed albumin, IMA)和髓过氧化物酶(myeloperoxidase, MPO)等新型标志物在 ACS 的早期诊断与评估中也发挥着重要的作用。
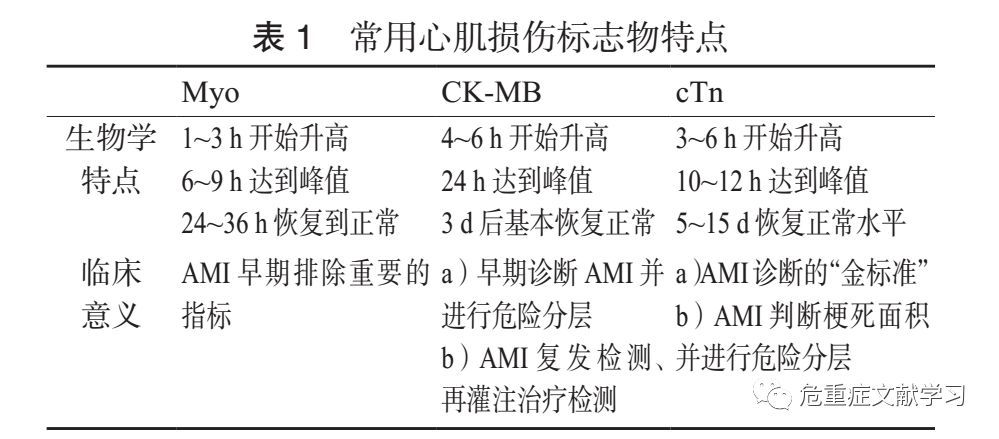
cTn 由三种不同的亚基组成:心肌肌钙蛋白 T(cTnT)、心肌肌钙蛋白 I(cTnI) 和心肌肌钙蛋白 C(cTnC)。心肌损伤后 3~6 h cTn 开始升高, 10~12 h 达到峰值, 5~15 d 恢复正常水平。 cTn 不仅是诊断急性心肌梗死(acute myocardial infarction, AMI)最常用的标志物,也可见于以下疾病 :急性和慢性心力衰竭、肾功能衰竭、心肌炎、中毒、快速性或缓慢性心律失常、心肺复苏术后、浸润性心脏疾病、心尖球型综合征、横纹肌溶解伴心肌损伤等 。
CK-MB 是 CK 的心肌同工酶,当心肌受损后, CK-MB释放入血,4~6 h开始升高,24 h达高峰,2~3 d后恢复正常 。
当不能测定 cTn 时,可选择 CK-MB 做为诊断 AMI 的重要指标。
MYO 在心肌或横纹肌损伤后 1~3 h 即可在血中检测到, 6~9h 达峰值, 24~36 h 恢复到正常水平。 MYO 释放早、排泄快速,与 cTn 或 CK-MB 联合应用有助于 AMI 的早期诊断。在临床实践中,应根据各种心肌损伤标志物的生物学特点灵活应用(表 1)。
4.2.2 心脏功能标志物
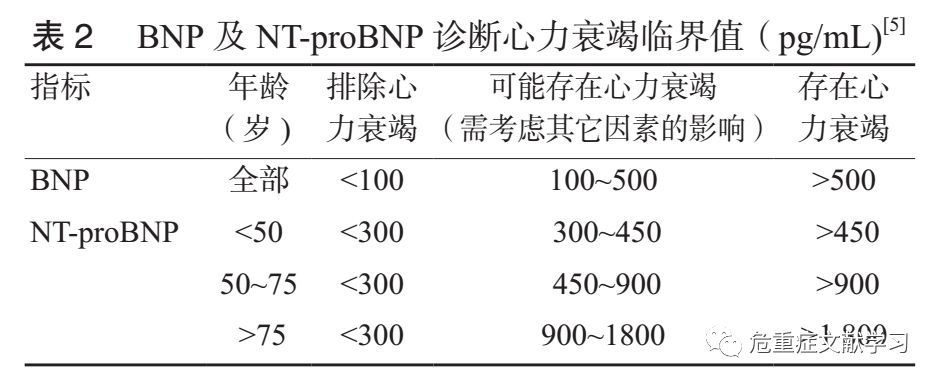
利钠肽作为心脏功能标志物不仅在心力衰竭早期诊断、预后判断方面具有重要价值,在急性胸痛的鉴别诊断、危险分层和预后判断等方面也具有重要作用。利钠肽家族中,脑钠肽(brain natriuretic
peptide, BNP)和氨基末端脑钠肽前体(N-terminal pro-Btypenatriuretic peptide, NT-proBNP)是目前最重要的心脏功能标志物,常用的临床参考值见表 2
4.2.3 出凝血标志物
D- 二聚体的水平增高反映了血浆中凝血系统和纤溶系统的激活,临床上将 D- 二聚体视为体内高凝状态和纤溶亢进的标志物。 D- 二聚体可作为 APE 诊断的首选筛查指标, D- 二聚体< 500 μg/mL 的可疑病例,如无法进行影像学检查,应动态检测 D- 二聚体水平 。 D-二聚体检测还可用于主动脉夹层的筛查和排除,研究发现以 500 μg/mL 作为临界值,其检测敏感度为 97%,阴性预测值为 96%,特异性为 56%,阳性预测值为 60% 。
凝血功能检测为手术前、抗栓治疗前患者的必查项目,目的是了解患者的出凝血功能有无障碍,是制定治疗策略的重要参考。
4.2.4 胸痛相关炎性标志物
C- 反应蛋白(c-reactiveprotein, CRP)是临床应用最广泛的炎症标志物。在 AMI的患者中, CRP 高峰可持续 48 h,且高峰值与心梗面积有关。同时, CRP >7.9 mg/L 时还预示着 AMI 后心脏收缩及舒张功能障碍,左室充盈压力的升高,远期心力衰竭发生率及病死率的增高 。
MPO 在炎症急性期由巨噬细胞及中性粒细胞释放,它的升高提示冠状动脉易损斑块炎症反应,可做为稳定型缺血性心脏病和 AMI 的标志物。
降钙素原(procalcitonin, PCT)是降钙素的前体,主要用于鉴别患者是否并发感染。
4.2.5 动脉血气分析
动脉血气分析是快速评估患者酸碱平衡、电解质水平的监测方法。高危胸痛患者可通过血气分析快速评估患者循环灌注情况,指导是否紧急处理 ;并可根据电解质水平及时对症处理,预防恶性心律失常的发生。动脉血气分析常用来鉴别 APE,多数 APE 患者PaO2<80 mmHg(1 mmhg=0.133 kPa)伴 PaCO2 下降。
4.2.6 血生化
血生化包括血清内各种离子、糖类、脂类、蛋白质以及酶、激素和机体的多种代谢产物。部分临床药物的应用需根据肝肾功能调整方案, K+、 Mg2+ 等电解质水平与恶性心律失常风险相关,胆固醇的基线水平将指导调脂药物的使用。生化检查可为医生提供诊断与治疗依据,并能帮助临床评估病情、监测治疗效果等。
4.2.7 生物标志物联合应用
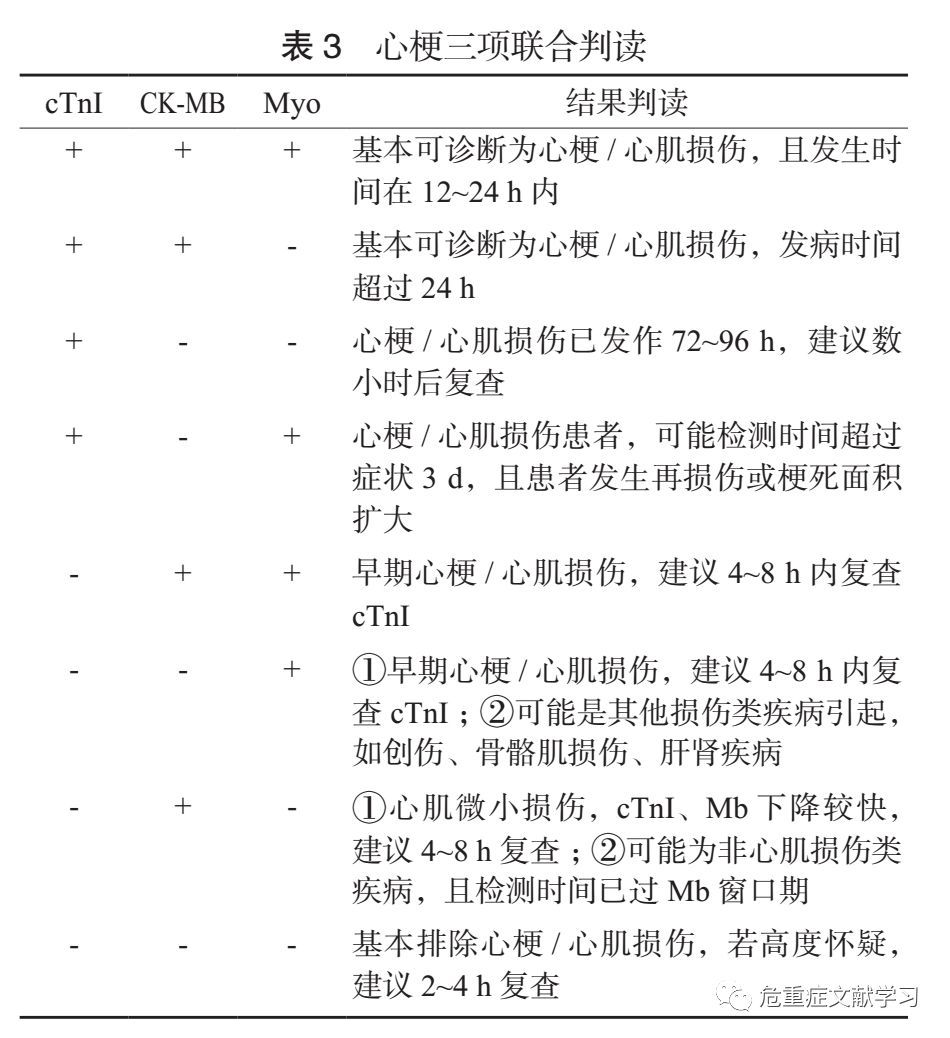
所有急诊接诊的急性非创伤胸痛患者,如果存在高危胸痛的危险因素及发病特征,且出现以下三种情况中的至少一种时,即血流动力学不稳定、心
电活动不稳定或心力衰竭,应及时对症处理,且尽早联合检测心肌损伤标志物(表 3)、 BNP/NT-proBNP 及 D- 二聚体 ;如果没有上述三种情况,可根据具体病因考虑,有针对性的检测一类或两类指标完成疾病的诊断或鉴别诊断,确诊后再联合其他检测指标实现危险分层和预后判断 。具体内容可参见相关专家共识。
4.3 床旁超声心动图
床旁超声心动图简便、快捷,能清晰显示心脏、大血管的结构和功能,为胸痛的鉴别诊断提供重要信息。
(1) 急性心肌梗死在超急性期心电图表现可能并不典型,甚至是“正常”的,完全性左束支传导阻滞可掩盖心电图图形而造成早期诊断困难。超声心动图可判断心肌是否存在节段性室壁运动异常,有助于 ACS 的鉴别、诊断。超声心动图能评估发生缺血的心肌的范围、程度,还能发现心肌缺血引起的一系列并发症,如缺血性二尖瓣反流、乳头肌断裂、室间隔穿孔及室壁瘤、附壁血栓等,同时还能评估心脏的功能 。
(2) 急性主动脉夹层
超声表现为主动脉腔内出现飘摆颤动的线性回声,剥脱的内膜将管腔分为真腔与假腔两个部分。超声可直观显示内膜剥离的范围、程度、破口位置、主动脉内径。除此之外,还可以显示 AD 相关并发症,包括重度主动脉瓣反流、心包填塞等,有助于临床医生选择最佳的手术时间及手术术式。
(3) 急性肺栓塞超声
直接征象为发现肺动脉近端或右心腔血栓 ;间接征象多是右心负荷过重的表现,主要为右室和(或)右房的扩大、室间隔运动异常、三尖瓣反流、肺动脉压力增高及肺动脉主干和分支扩张等 。如果二维超声心动图没有发现右心功能负荷过重或功能紊乱,一般不考虑严重的急性肺栓塞。下肢血管超声检查有助于筛查肺栓塞的栓子来源。
4.4 X 线检查
X 线检查是诊断气胸最常用的方法,可显示肺萎缩程度、胸膜粘连、纵隔移位及胸腔积液等。气胸侧透明度增强,无肺纹理,肺萎缩于肺门部,和气胸交界处有清楚的细条状肺边缘,大量气胸时纵隔可向健侧移位,尤其是张力性气胸更显著 ;少量气胸则占据肺尖部位,使肺尖组织压向肺门 ;如有液气胸则见液平面 。
4.5 CT 及 CT 血管造影(CTA)检查
(1) 气胸可通过 CT 检查明确诊断, CT 对胸腔内少量气体的诊断较为敏感。对反复发作的气胸、慢性气胸患者观察肺边缘是否有造成气胸的病变,如肺大疱、胸膜带状粘连,肺组织牵拉、裂口不易闭合等。气胸表现为胸膜腔内出现极低密度的气体影,伴有肺组织不同程度的压缩 。
(2) 急性主动脉夹层可通过 CTA 明确诊断,敏感性达 90% 以上、特异性接近 100%,主要表现包括 :血管直径增大征或巨大的夹层动脉瘤 ;血管内膜征,主动脉管腔内发现动脉内膜片提示夹层或壁间血肿 ;钙化点征,正常主动脉钙化点一般在主动脉外周,当血管内出现内移的钙化点,提示内膜片内移 。 CTA 检查可显示主动脉真、假腔和血管直径,还包括内脏动脉位置和假腔内血栓情况,是临床最常用的辅助检查方法。
(3) 肺栓塞可通过 CTA 明确诊断,但对于亚段及外周肺动脉的栓子其敏感性有限。资料显示, CTA 对于 PE诊断的敏感性为 53% ~ 100%,特异性为 78% ~ 100%。
5 常见高危胸痛的救治策略
5.1 急性冠脉综合征
5.1.1 急性 ST 段抬高型心肌梗死((ST-segment elevation myocardial infarction, STEMI) STEMI 患者的救治要以缩短总的心肌缺血时间、恢复有效心肌再灌注为根本治疗理念。怀疑 STEMI 的患者要尽快完成心电图、 POCT、床旁超声等辅助检查。需根据病情复查心电图、 POCT 等。明确 STEMI的患者可根据现实条件选择合适的再灌注策略 ,包括直接PCI(primary PCI, PPCI)、转运 PCI 或静脉溶栓治疗、溶栓后转运 PCI 和溶栓 - 介入序贯再灌注治疗等 。
5.1.2 非 ST 段抬高的急性冠脉综合征(non ST segment elevation acute coronary syndrome, NSTE-ACS) 由 于NSTE-ACS 患者的病情严重程度差异大,应建立基于危险分层的治疗策略,根据病情危险程度分层施治,常用的评分模型包括 GRACE 风险评分和 TIMI 风险评分 。初步评估或再次评估明确为极高危的患者,应在 2 h 内实施紧急介入治疗,对高危患者指南建议选择 24 h 内行早期介入治疗,对于症状或缺血反复发作的中危患者可在 72 h 内选择介入治疗。不具备 PCI 能力的医院,应与具备 PCI 能力的医院合作,建立联络及转诊机制 。一旦 NSTE-ACS进展为 STEMI,应立即按 STEMI 再灌注治疗流程执行后续治疗。评估为高危或中危患者诊疗流程,需按规定时间内接受早期或延迟介入治疗或及时转运。
5.1.3 ACS 合并急性心力衰竭(acute heart failure, AHF)的早期预警 急性心力衰竭是 ACS 常见和重要的并发症之一, GRACE 研究表明 ACS 合并急性心力衰竭患者在院内及发病 6 个月内的生存率明显降低。
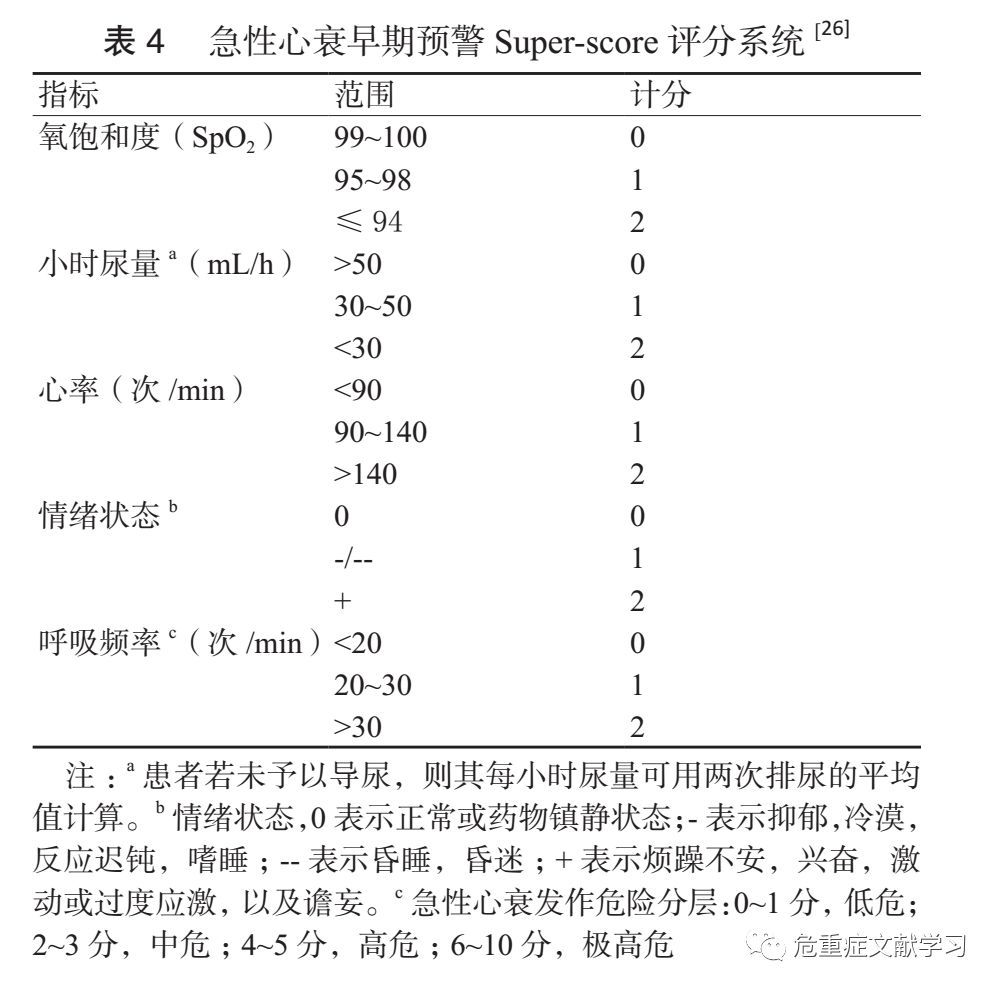
急性心衰以及心衰高危患者住院期间可能再次、反复发作,严重影响患者的生活质量和远期预后。推荐高危ACS 患者采用“急性心衰早期预警 Super-score 评分系统”,即以氧饱和度(S)、小时尿量(U)、心率(P)、情绪状态(E)呼吸频率(R)这 5 个指标组成的 Super-Score 评分模型为指导,动态监测高危患者病情变化,总分 10 分,建议高危患者每小时评分 1 次,理论上提前 2~6 h 预测患者急性心衰发作,以此为指导可以开展急性心衰的早期预警、提前干预 ,见表 4。
5.1.4 ACS 的药物治疗 抗栓是 ACS 药物治疗的基石,明确诊断并排除出血后需立即启动抗栓治疗,临床上应综合评估患者的缺血和出血风险,制定个体化的抗栓策略。再灌注、抗栓治疗的同时,改善心肌微循环、抗心肌缺血、防治心室重构等也是改善 ACS 患者症状和预后的重要手段。
抗栓治疗包括 :
(1) 抗血小板治疗 . ①排除出血等禁忌后, ACS 患者初始需服用阿司匹林负荷剂量后长期维持 。② ACS患者应联合一种血小板 P2Y12 受体抑制剂,服用 P2Y12 受体抑制剂负荷剂量后,推荐双联抗血小板治疗维持至少 12个月 。③对于没有禁忌证的 ACS 患者,指南推荐 P2Y12受体抑制剂为替格瑞洛 ;拟行早期侵入性治疗的 STEMI 及中高危的 NSTE-ACS 患者,最新指南也推荐使用替格瑞洛,在无法使用替格瑞洛时给予氯吡格雷 ;接受溶栓治疗的患者,氯吡格雷使用常规负荷剂量,溶栓治疗后推荐使用维持双抗治疗 。④ STEMI 及中高危 NSTE-ACS 患者,若存在高血栓风险等因素(如,肌钙蛋白阳性、 ST 段改变、合并糖尿病、再发心梗), 可在接受介入治疗前给予血小板糖蛋白(glycoprotein , GP)Ⅱ b/ Ⅲ a 受体拮抗剂; 考虑到双抗起效时间、患者呕吐、手术策略及效果等因素,可
在 PCI 术中、术后给予 GP Ⅱ b/ Ⅲ a 受体拮抗剂 。三种常见的 GP Ⅱ b/ Ⅲ a 受体拮抗剂中,替罗非班相对分子质量最小,可逆性较强,出血风险相对较小,在临床中应用较广泛。
(2) 抗凝治疗。①所有 STEMI 患者无出血禁忌时均应早期使用肝素 ;②溶栓或错过早期血运重建时间窗的患者应至少接受 48 h 抗凝治疗,最多持续 8 d 或至血运重建 ;③接受 PCI 治疗的患者术中可使用普通肝素或比伐芦定抗凝,比伐芦定半衰期短、出血风险较低。临床医师需根据出血风险、肾脏功能等因素选择合适的抗凝方案。
(3) 溶栓治疗是 STEMI 患者再灌注治疗的重要方式之一,建议 :①不具备直接 PCI 条件或转运时间较长的医疗机构需选择新型静脉溶栓药物 ; ②有条件的院前急救系统转运患者时可开展院前溶栓 ; ③不能及时接受介入治疗的,也可在转运的同时开展溶栓 - 介入序贯再灌注治疗 。
溶栓剂的选择 :非特异性纤溶酶原激活剂出血风险高、再通率较低,不建议首选。瑞替普酶、阿替普酶、奈替普酶、重组人尿激酶原等特异性纤溶酶原激活剂能选择性地与血栓表面的纤维蛋白结合,而不影响纤溶系统,血管再通率高且出血风险较低,临床应用较广泛。冠脉高血栓负荷的患者可选择冠脉内溶栓策略。
其他药物治疗包括 :
(1) β 受体阻滞剂。既有利于缩小梗死面积改善心室重构,又能减少心力衰竭发生、心源性猝死、再发心肌梗死、恶性心律失常等事件,可显著降低患者的病死率并改善患者预后 。无禁忌证的患者应在发病 24 h 内常规服用,并逐渐加量。
(2) 他汀类药物。多项研究显示 ACS 早期他汀治疗可显著降低心血管事件风险,无禁忌的 ACS 患者应尽早开始。最新指南推荐 STEMI 患者如无禁忌证,应尽早启动高强度他汀治疗并长期维持 。应用他汀类药物的获益来源于 LDL-C 的降幅 。目前常用的他汀类药物包括 :辛伐他汀、氟伐他汀、阿托伐他汀、瑞舒伐他汀等。
(3) ACEI/ARB。 PCI 围 术 期 及 术 后 长 期 合 理 应 用ACEI/ARB 类药物可改善心肌重构并改善预后 。在无禁忌证的情况下应早期(STEMI 发病 6~12 h 后)开始使用ACEI,但剂量和时限仍视病情而定,不能耐受 ACEI 者用ARB 代替 。
(4) 醛固酮受体拮抗剂 . 通常在 ACEI 治疗基础上使用, STEMI 后心功能减退,排除禁忌证后应使用醛固酮受体拮抗剂 。
(5) 抗心肌缺血治疗。β 受体阻滞剂、硝酸酯类药物、钙拮抗剂是常用的抗心肌缺血药物,临床中需根据患者的血压、心律(率)、梗死范围等因素选择合适的药物。在改善冠状动脉大血管血流的同时,冠状动脉微循环逐渐成为心肌再灌注的重要靶点 。
(6) 改善心肌代谢药物。通过调节心肌代谢而发挥心肌保护作用,不影响冠脉的血流动力学。主要包括 :卡尼汀及其衍生物、脂肪酸氧化抑制剂、肉毒碱脂酰转移酶抑制剂、极化液等 。
(7) 改善心肌微循环药物。冠脉微循环疾病(coronary microvascular disease, CMVD)可直接影响心肌细胞代谢及心脏功能,甚至决定心血管疾病的发生、发展、疗效及预后,是 STEMI 再灌注治疗后心脏功能恢复的重要因素 。
PPCI 术中或术前使用 GP Ⅱ b/ Ⅲ a 受体拮抗剂、冠脉内给予硝酸甘油、腺苷、尼可地尔、硝普钠、前列地尔等药物可降低 CMVD 的发生 。
5.2 急性主动脉夹层
经临床初步评估高度怀疑 AAD 的患者,应立即入胸痛诊间进行监护,限制活动,并尽快完成体格检查。同时,需尽快完成血常规及血型、血气分析、心肌损伤标志物、凝血功能、血生化等检测,以辅助诊断并为手术治疗做准备。应尽快给予有效镇痛(可适当肌注或静脉应用阿片类药物)、控制心率和血压(建议静脉应用 β 受体阻滞剂),控制夹层发展,降低主动脉夹层破裂的风险 。理想控制目标为心率 60 ~ 80 次 /min 和收缩压 100 ~ 120 mmHg。尽快完成床旁心电图、超声心动图等辅助检查。在有效镇痛、心率血压控制稳定后,尽快完成主动脉 CTA 检查,明确急性主动脉夹层的分型及受累范围,为手术方案的选择提供依据。不具备大血管介入和手术能力的医疗机构,应当建立完善的急性主动脉夹层转诊机制。告知患者家属转运可能存在的风险,制定转运途中发生意外情况的预案,药物治疗相对平稳后尽快转至具备手术条件的医疗机构。
5.3 急性肺栓塞
APE 患者入院后须尽快完成心电图检查,并行血气分析、 D- 二聚体、 BNP、 cTn 等检测。有条件的医院应尽快完成肺动脉 CTA,以明确诊断并危险分层。
根据 Wells 评分或 PESI 分级等评估手段动态评估患者,对于高危肺栓塞患者,应尽快完成床旁超声检查,尽快进行抗凝治疗。对于排除溶栓禁忌证的患者,及时给予静脉溶栓治疗。有溶栓禁忌证者应考虑导管碎栓、溶栓或手术取栓 ;连续动态监测血压,限制活动。中低危组 :应住院或门诊抗凝治疗,并密切观察、动态评估病情,依据凝血指标调整抗凝药物的剂量,既保证抗凝药物的有效性,又尽量减少出血 。
5.4 张力性气胸患者
所有考虑张力性气胸的患者,均应当立即进入胸痛诊间或抢救室,待确诊后应立即施行胸腔穿刺术(穿刺位置常为患侧锁骨中线第 2 肋间,可使用粗针头穿刺排气),予紧急排气、减压。
穿刺减压同时需进行床旁 X 线或胸部 CT 检查 ;若条件允许,亦可先行胸腔闭式引流术,再行相关检查。若医疗机构不具备胸腔闭式引流术条件,应当对张力性气胸患者实施紧急胸腔穿刺减压后转诊。
6 胸痛中心建设
胸痛中心是整合院内外多学科医疗资源、采用标准化的诊治流程、强调以患者为中心的胸痛救治平台。通过信息共享、多学科协作诊疗(multidisciplinary team, MDT)等多种模式,胸痛中心的建设将保障急性胸痛患者到达医院后得到早期评估、危险分层、正确分流与合理救治,既避免高危患者的漏诊,使其得到及时诊断、及时治疗、改善预后,并尽可能减少低危患者住院检查和治疗的医疗费用。
院前急救、急诊科和心内科是胸痛中心建设的主要参与者,多学科协作是缩短救治时间、提高救治效率的关键。近年来,我国胸痛中心建设积累了大量经验并取得了长足的进步,然而,院前急救和急诊科仍是大部分医疗机构胸痛中心建设的薄弱环节。本共识结合我国胸痛中心建设的推广,进一步强调了基层医疗机构和急救医疗系统之间的联动、规范了院前急救和急诊科的诊断和治疗流程。本共识的发布必将有利于指导院前急救和急诊科更加合理的抢救、评估、分流胸痛患者,快速提升急性胸痛急诊诊疗能力。
TEL:027-87808005

Copyright © 2024 武汉明德生物科技股份有限公司版权 | 鄂ICP备12000100
互联网药品信息服务资格证书 [(鄂)-非经营性-2016-0005]
 鄂公网安备 42011502000634
鄂公网安备 42011502000634
